Pour réaliser le groupage ou le phénotypage sanguin d'un individu, les laboratoires possèdent plusieurs techniques qui ont évolué avec les progrès techniques scientifiques. Ces techniques consistent à mettre en évidence par une réaction d'agglutination les antigènes présents à la surface des globules ou les anticorps du plasma. Cette hémagglutination peut-être visible à l’œil nu en milieu salin à température du laboratoire : elle est dite directe dans le cas d’anticorps IgM ou alors nécessiter des artifices par exemple par modification du milieu, ajout d’enzymes protéolytiques ou anticorps anti-anticorps (antiglobuline).
Agglutination spontanée
Cette agglutination est provoquée lorsqu'un anticorps, de type IgM essentiellement, rencontre l'antigène correspondant. Il se forme alors un réseau d'antigènes-anticorps (cf. image ci-dessous) qui est visible à l'oeil. Cela se caractérise par un amas de globules rouges avec un éclaircissement de la solution réactionnelle. La visibilité de cette agglutination est due à la capacité de ces anticorps à créer un réseau avec les hématies.
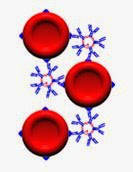
Les IgG par leur caractère monomère n'ont pas le pouvoir d'agglutination directe, sauf pour l'IgG3 qui a une fraction Fc plus longue. Cette fraction lui permet de créer un réseau par adhérence des fractions Fc entre elles.
Pour mettre en évidence les hémagglutinations spontanées et ainsi déterminer le groupe ou le phénotype d'un patient, il existe plusieurs techniques.
Technique saline en tube ou en plaque alvéolée :
Cette technique consiste à mettre en contact l'antisérum avec les globules rouges dilués du patient dans un tube à essai. Dans le cas de la technique en tube, celui-ci est centrifugé de façon modérée pour rassembler les hématies au fond puis une agitation douce remet le culot en suspension avec soit un ou des amas (agglutination) ou alors dispersion des hématies libres (non agglutination). Dans la technique en plaque alvéolée, après dépôt des réactifs et composants sanguins, la plaque est soumise à un roulis qui permet après 1 à 2 minutes de voir apparaitre des amas de complexes immuns ou alors une suspension globulaire inchangée.
Cette méthode est très utilisée lors de difficultés de groupage sanguin, car elle permet une meilleure visibilité réactionnelle entre l'anticorps et l'antigène.
Microplaque :
Cette technique comme celle en tubes met en présence des plasmas et les globules rouges avec centrifugation puis remise en suspension des culots. Elle a été mise en place afin de permettre l'automatisation de la méthode en tube. La réaction se fait donc dans des micro-cupules positionnées sur une plaque. La lecture de la réaction est réalisée par le lecteur de l'automate. Cette technique nécessite l'utilisation d'une enzyme protéolytique, la bromeline, qui permet de diminuer le potentiel zêta des globules rouges afin de faciliter le contact des anticorps avec les antigènes et ainsi accélérer la réaction d'hémaglutination.
La société Diagast a innové cette technique avec la magnétisation des hématies. Cette magnétisation a permis de supprimer la centrifugeuse sur l'automate et ainsi gagner de la place. Après incubation, les hématies sont attirées au fond de la cupule par un champ magnétique puis une agitation modérée remet en suspension les culots avec amas de complexes immuns ou alors suspension globulaire inchangée.
Filtration :
Cette technique nécessite l’utilisation de cassettes formées de micro-cupules contenant du gel ( ou des micro-billes) et l’antisérum de l’antigène à rechercher formant une colonne de filtration. Les globules rouges sont déposés à la surface de cette colonne. Suite au dépôt, la cassette est centrifugée pour entrainer les globules rouges en bas de la colonne. S’il y a formation d’immuns complexes, ce réseau reste en haut de la colonne car la taille de ces derniers empêche leur migration vers le bas de la colonne. Ce complexe immun va donc avoir une taille plus importante qu'initialement et va être bloqué par les billes ou le gel. Il ne va donc pas atteindre le fond de la colonne. Cette technique est également utilisée par des automates.
Test indirect à l'antiglobuline (TIA)
Ce test permet, grâce à un sérum antiglobuline humaine, de révéler la présence d'anticorps spécifique fixé sur l'antigène correspondant à la surface de l'hématie, non visible spontanément.
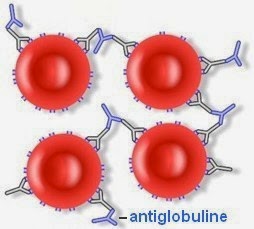
Le test de coombs indirect est utile dans la détermination de certains phénotypes érythrocytaires ou bien dans la recherche des agglutinines présentes dans le sérum. La réaction comporte deux temps :
- fixation de l'anticorps sur les hématies par l'incubation de la suspension globulaire avec le sérum étudié, pendant plusieurs minutes,
- après éventuellement un lavage des hématies en milieu salin (destiné à éliminer toute trace d'immunoglobulines sériques libres qui risqueraient d'inhiber l'antiglobuline), les hématies sont mises en présence du sérum antiglobuline qui permet la mise en évidence de l'éventuelle réaction positive, par la création d'un réseau.
Ce test à l'antiglobuline est utilisé pour des techiques en tube et en filtration. Dans le cas de la technique en filtration, le lavage des hématies n'est pas nécessaire.
Technique saline :
La technique de départ est la même que lors d'une agglutination spontanée. Mais après la centrifugation, les globules rouges sont lavés à l'eau physiologique (eau contenant du NaCl). Ces étapes de lavage permettent d'éliminer les anticorps libres de l'antisérum et ainsi éviter qu'ils ne saturent les Fab de l'antiglobuline. L'antiglobuline est ensuite ajoutée puis le tube est de nouveau centrifugé. L'antiglobuline va donc créer un réseau entre les complexes immuns, révelant ainsi l'agglutination.
Filtration :
Cette méthode utilise des cassettes contenant une micro-cupule surmontant une colonne de filtration d'antiglobuline. L'antisérum est ajouté aux globules rouges du patient dans la micro-cupule. La cassette est ensuite incubée 15 à 20 minutes à 37°C avant d'être centrifugée. Lors de cette centrifugation, les globules rouges vont migrer au fond du tube. L'antiglobuline contenue dans la colonne de filtration, va se fixer sur les hématies sensibilisées lors de l'incubation dans la micro-cupule. Ce nouveau complexe va donc avoir une taille qui va l'empêcher de migrer dans la colonne de billes. Dans cette technique, le lavage des hématies n'est pas nécessaire, car la concentration en antiglobuline est importante dans la cassette, limitant le risque de saturation des Fab de l'anglobuline.
Immuno-adhérence
Le méthode consiste à fixer préalablement les hématies du patient sur les parois des cupules de la microplaque. L'antisérum du phénotype à déterminer est ensuite ajouté à la cupule afin de permettre la rencontre entre les hématies et l'antisérum. Après incubation, la cupule est lavée avec une solution saline 0,15 M pour éliminer les protéines non spécifiquement fixées. Les anticorps ayant été fixés sur les antigènes sont mis en évidence par immunoadhérence à l'aide d'hématies révélatrices sur lesquelles est fixée de l'antiglobuline humaine. Les plaques sont ensuite centrifugées. Une réaction négative est caractérisée par un bouton cellulaire au centre de la cupule.
Autres techniques
Il existe d'autres techniques mais moins utilisées à l'heure actuelle :
- Cytométrie de flux
- ELISA
- Immunofluorescence