Membrane du globule rouge
La membrane érythrocytaire assure au globule rouge sa forme biconcave, sa plasticité et sa déformabilité. Elle porte également des déterminants de groupes sanguins et représente un modèle idéal pour l'étude de la structure et des fonctions des membranes cellulaires. Elle représente une mosaïque fluide constituée d'une matrice lipidique disposée en une double couche dans laquelle flottent et se déplacent des protéines globulaires. Les composants glucidiques, lipidiques et protéiques ne se répartissent pas d'une manière équivalente sur les faces externes et internes de la membrane.

Glucides :
Les glucides de la membrane du globule rouge sont des structures linéaires ou branchées, liées de manière covalente aux protéines et aux lipides membranaires. Ils sont situés sur la face externe de la cellule. Certains groupes sanguins ABH, i, I, Lewis, P sont localisés sur ces chaînes glucidiques, liés à des glycolipides et/ou glycoprotéines de la membrane du globule rouge. On suppose que ces structures glucidiques doivent jouer un rôle fondamental dans les relations entre les cellules vivantes. Elles sont propablement concernées par de nombreuses fonctions, telles que les mécanismes de reconnaissance cellulaire, l'adhésion cellulaire et l'inhibition de contact. Sur cette base, le rôle des antigènes de groupes sanguins dans l'embryogénèse ou la cancérogénèse pourrait être d'une certaine importance.
Lipides :
Les lipides de la membrane du globule rouge jouent un rôle important dans son organisation propre et dans ses échanges avec le plasma. Les phospholipides qui en représentent le principal composant, sont disposés en une structure en double couche : les glycosphingolipides.
Phospholipides :
Les phospholipides sont disposés en une double couche dans laquelle la chaîne aliphatique de la molécule est éloignée du milieu aqueux, tandis que les groupements polaires des têtes hydrophobes se trouvent en contact direct avec le milieu externe et le cytoplasme. La répartition des lipides dans la double couche n'est pas homogène puisque l'on trouve préférentiellement la sphingomyéline et la phosphatidylcholine dans le feuillet externe, la phosphatidyléthanolmaine et la phosphatidylsérine dans le feuillet interne. Ces molécules lipidiques sont très mobiles, mais seulement à l'intérieur de leur propre couche.
Squelette membranaire
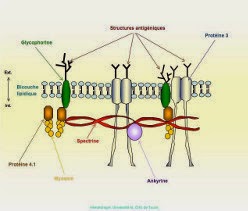
La spectrine et les polypeptides qui lui sont associés définissent le squelette membranaire et sont responsables de la forme du globule rouge et de sa déformabilité. Il est possible qu'ils contribuent également à la stabilité de la bicouche lipidique. La spectrine est la plus abondante des protéines de la membrane (30%). Elle est composée de deux chaînes polypeptidiques homogènes distinctes isolées sous forme d'un hétérodimère.
L'actine érythrocytaire est constituée de protofilaments courts de 33 nm environ, assemblés à partir d'environ 12 sous unités monomériques, stabilisés par la tropomyosine. L'actine et la spectine constituent le réseau filamenteux protéique principal du squelette membranaire.
La protéine 4.1 est une phosphoprotéine globulaire composée de deux sous unités quasi identiques. Cette protéine stabilise l'association spectine-actine et représente un premier point d'attache du squelette membranaire sur la face interne de la membrane par interaction avec la glycophorine C.
L'ankyrine (bande 2.1) a pour rôle majeur l'ancrage du squelette membranaire sur la face interne de la double couche lipidique grâce à sa fixation d'une part sur la chaîne de spectrine et d'autre part sur le fragment cytoplasmique de la bande 3.
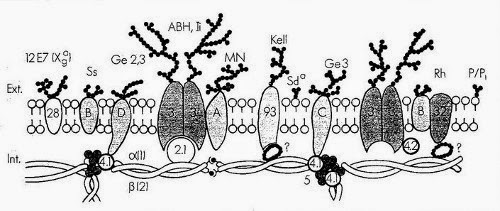
Le canal anionique de la membrane du globule rouge (bande 3) est une protéine transmembranaire qui représente 25% environ de la masse totale des protéines du globule rouge. Cette molécule traverse 10 à 12 fois la membrane et présente une polarité qui est à l'inverse de celle de beaucoup d'autres protéines membranaires car sa région N-terminale se situe du côté cytoplasmique et la partie C-terminale est sur la face externe de la membrane. La bande 3 est une glycoprotéine comportant une chaîne N-glycanique constituée d'unités répétitives de N-acétylactosamine portant les spécificités antigéniques ABH et Ii. L'intérêt de cette protéine tient à ses fonctions biologiques, car elle assure le transport électroneutre des anions (Cl-, HCO3-) à travers la membrane. Il s'agit d'un rôle clé dans le mécanisme général de transport du CO2 des tissus vers les poumons car il permet l'élimination du HCO3 intracellulaire (hydration du CO2). La queue cytoplasmique de la bande 3 représente un site de fixation de plusieurs protéines périphériques telles que l'aldolase, la bande 6, la bande 4.2, la glycophorine A et l'ankyrine.
La glycophorine A est la plus grande partie de la charge électrique négative (80%) du globule rouge et porte les antigènes M et N. Elle est la sialoglycoprotéine majeure du globule rouge.
La glycophorine B est une glycoprotéine transmembranaire. Elle porte des antigènes de groupes sanguins S, s et U et se caractérise par une importante homologie de séquence avec la glycophorine A.
Les glycophorines C et D portent les antigènes de groupe sanguin Gerbich et jouent un rôle important dans la stabilité et le maintien des propriétés mécaniques de la membrane en permettant l'ancrage, via la protéine 4.1, du cytosquelette sur la face interne de la membrane érythrocytaire.
Hémoglobine
L'hémoglobine permet la fixation de l'oxygène sur les globules rouges afin de la transporter jusqu'aux différents tissus de l'organisme pour en assurer leur oxygénation (O2). En retour, elle va transporter le dioxyde de carbone (CO2).
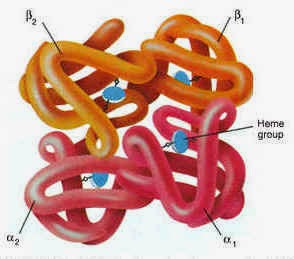
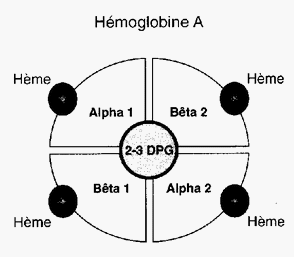
Chaque molécule d’hémoglobine est un tétramère formé par l’association de quatre chaînes polypeptidiques identiques deux à deux : deux chaînes alpha (ou globines alpha) composées chacune de 141 acides aminés et deux chaînes bêta (ou globines bêta) de 146 acides aminés. Chacune des chaînes adopte une conformation spatiale lui donnant une forme globuleuse et ménageant une « poche » superficielle dans laquelle se trouve logé le hème, structure non protéïque contenant un atome de fer (c'est à ce niveau que se lie l'oxygène). La cohérence du tétramère (structure quaternaire de l’hémoglobine a2-b2) résulte de liaisons dues aux chaînes latérales hydrophobes des acides aminés situés à la périphérie de chaque globine.