Il existe 5 classes d'immunoglobulines (anticorps) : IgG, IgA, IgM, IgD et IgE. En Immuno-Hématologie, ce sont essentiellement les IgG et les IgM qui entrent en jeu dans les diverses applications médicales de cette discipline. Ces immunoglobulines se différencient par leur composition, leur charge et leur poids moléculaire.
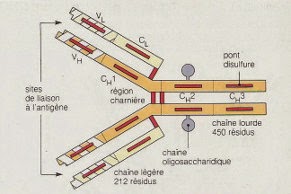
La structure de base des anticorps est constituée de deux chaînes polypeptidiques légères identiques et de deux chaînes polypeptidiques lourdes identiques reliées entre elles par des ponts disulfures.
Structure des IgG
La molécule d'IgG est l'exemple type de la structure de base de l'anticorps. La chaîne légère d'une IgG a 2 ponts disulfures intracaténaires, un dans la région variable et l'autre dans la région constante. La chaîne lourde, deux fois plus longue, a 4 ponts disulfures intracaténaires. Pour la chaîne légère, ces domaines sont appelés VL et C pour régions variable et constante, respectivement. La région N-terminale de la chaîne lourde est appelée VH et la région constante des chaînes lourdes est formée de 3 régions constantes CH1, CH2 et CH3.
Les IgG sont divisées en 4 sous-classes : IgG1, IgG2, IgG3 et IgG4. Ces sous-classes se différencient notamment par le nombre de liaisons entre les chaînes lourdes : 2 pour IgG1 et l'IgG4, 4 pour l'IgG2 ou 15 pour l'IgG3. Elles présentent également des différences sur l'organisation des ponts disulfures intercaténaires; pour l'IgG1, les ponts disulfures se trouvent dans la zone de la région charnière alors que pour les autres, ils vont jusqu'à la zone de jonction entre la région variable et la région constante.
Ces différentes sous-classes sont réparties de façon équivalente en intra et en extravasculaire et constituent la classe principale d'immunoglobulines produite au cours de la réponse immunitaire secondaire. Mais les concentrations des différentes sous-classes sont très variables : IgG1 66% (6,6 g/L), IgG2 23% (3,2 g/L), IgG3 7% (0.58 g/L) et IgG4 4% (0,46 g/L). Toutes ces IgG franchissent la barrière placentaire. Par contre, les IgG1 et les IgG3 activent fortement le complément, alors que les IgG2 faiblement et les IgG4 pas toutes. Les anti-IgG3 sont les anticorps les plus dangereux tant pour les transfusions sanguines que lors des grossesses, suivis des IgG2, IgG1 et IgG4; pour la destruction d'une hématie, il faut 100 IgG3 fixées dessus alors que pour l'IgG1, il faut 900 à 1000 anticorps.
Les IgG représentent 75% (12 g/L) des immunoglobules totales et ont une demi-vie de 3 semaines pour les IgG1, IgG2 et IgG4; alors que les IgG3 ont une demi-vie de 7,1 jours.
Structure des IgM
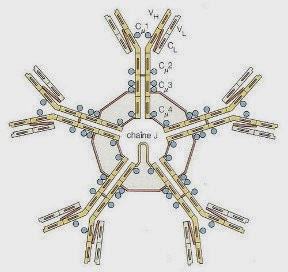
Les anticorps de type IgM sont des pentamères de l'unité de base, formés de 2 chaînes lourdes et de 2 chaînes légères. Les 5 sous-unités sont reliées par des ponts disulfures et une chaîne J, conférant à la molécule un aspect caractéristique avec une région centrale très dense d'où émergent des bras latéraux.
Les anticorps de type IgM sont caractérisés par une flexibilité permettant à une seule molécule d'IgM liée à l'antigène d'activer le complément. Ce changement conformationnel de la molécule permet l'exposition d'un anneau de fixation du C1q, normalement masqué dans la conformation originelle en étoile.
Elle correspond à 10% (0,5 à 2 g/L) des anticorps en intravasculaire et a une demi vie de 5 jours.