Hématopoïèse
L'hématopoïèse est l'ensemble des phénomènes qui concourent à la fabrication et au remplacement continu et régulé des cellules sanguines. L'hématopoïèse assure donc une production quantitativement très importante. Chaque jour, elle produit environ 1013 cellules sanguines. Ceci correspond par exemple à la production de plus de 2 millions d'hématies par seconde.
Cette considérable activité de production est assurée par une petite population de cellules de la moelle osseuse appelées cellules souches hématopoïétiques. Elle doit, de plus, être contrôlée afin de maintenir à peu près constant le nombre de cellules sanguines malgré des variations de consommation importantes liées à des circonstances pathologiques (hémorragies, infections ...). Cette régulation repose sur des mécanismes cellulaires et humoraux (facteurs de croissance) qui peuvent être stimulateurs ou inhibiteurs de l'hématopoïèse.
 Après la naissance, l'hématopoïèse normale est localisée exclusivement dans la moelle osseuse. Jusqu'à l'âge de 5 ans, tous les os ont une activité hématopoïétique. Ensuite, cette activité va progressivement se limiter au niveau des os courts et plats (sternum, côtes, vertèbres, os iliaques).
Après la naissance, l'hématopoïèse normale est localisée exclusivement dans la moelle osseuse. Jusqu'à l'âge de 5 ans, tous les os ont une activité hématopoïétique. Ensuite, cette activité va progressivement se limiter au niveau des os courts et plats (sternum, côtes, vertèbres, os iliaques).
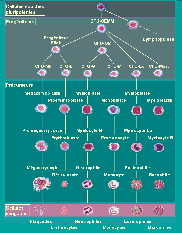
Toutes les cellules sanguines (hématies, polynucléaires, monocytes, lymphocytes et plaquettes) sont produites à partir d'une même cellule indifférenciée dite cellule souche multipotente ou cellule souche primitive. Sous l'influence de facteurs stimulants une cellule souche multipotente va s'engager dans la différenciation d'une lignée cellulaire. Elle devient alors un progéniteur (cellule souche différenciée ou " engagée ").
Après plusieurs divisions qui aboutissent à des cellules souches engagées à la potentialisation de différenciation de plus en plus limitée, les progéniteurs deviennent spécifiques d'une seule lignée. On aboutit alors aux précurseurs, cellules identifiables morphologiquement sur un prélèvement de moelle osseuse. Ces précurseurs se divisent et maturent. Ils correspondent à la majorité des cellules vues sur un étalement de myélogramme ou sur une biopsie ostéomédullaire (BOM). La maturation terminale aboutit aux cellules matures fonctionnelles qui passent dans le sang.
L'efficacité et le rendement de l'hématopoïèse seraient très faibles si à chaque précurseur ne correspondait qu'un seul élément figuré mature. Aussi, parallèlement à la maturation, chaque stade cytologique correspond à une division cellulaire. Selon les lignées, il se produit ainsi entre 3 et 5 mitoses, de sorte qu'un précurseur peut donner naissance à 32 cellules filles.
Régulation de l'hématopoïèse
Trois éléments jouent également un rôle important pour obtenir une hématopoïèse correcte et régulée:
- Le microenvironnement médullaire participe à l'organisation générale de la moelle. Il donne aux cellules souches les conditions anatomiques et intercellulaires satisfaisantes pour assurer l'hématopoïèse. Le stroma médullaire est formé de différent types de cellules: fibroblastes, cellules endothéliales, macrophages, cellules épithéliales et adipocytes. Ces cellules du stroma sont organisées au sein des logettes hématopoïétiques. Elles sécrètent des matrices extracellulaires et des facteurs de croissance. Les matrices extracellulaires permettent l'adhésion des cellules souches en particulier grâce au collagène.
- Des vitamines et oligoéléments sont indispensables à l'hématopoïèse. Certains agissent sur l'ensemble des lignées cellulaires. C'est le cas de la vitamine B12 et de l'acide folique qui sont nécessaires à la synthèse de l'ADN et donc à la division cellulaire. Ces vitamines sont dites antimégaloblastiques. Leur déficit entraînera des anomalies de formation dans toutes les lignées. D'autres sont nécessaires à la fabrication de protéines spécifiques de lignées. C'est le cas du fer, indispensable à l'érythropoïèse pour la synthèse de l'hémoglobine.
- Les facteurs de croissance : L'étude des cellules souches par culture de moelle in vitro a montré la nécessité de "facteurs de croissance hématopoïétiques" pour la survie, la différenciation, la multiplication et la maturation des cellules de l'hématopoïèse. Le premier facteur connu a été l'érythropoïétine (EPO). Depuis quelques années de nombreux autres facteurs ont été découverts, clonés et synthétisés. Leur rôle exact dans l'hématopoïèse est de mieux en mieux défini. Ils permettent de grands espoirs dans le traitement des maladies de l'hématopoïèse et certains sont déjà utilisés en thérapeutique.
Vitamines Antimégaloblastiques
La vitamine B12 et les folates sont appelés vitamines antimégaloblastiques. En cas de carence en l'un de ces facteurs, une hématopoïèse inefficace s'installera et aboutira à un état pathologique de toute l'hématopoïèse, mais nommé "anémie mégaloblastique" car les effets les plus nets seront constatés sur l'érythropoïèse.
La conséquence commune des modes d'action de la vitamine B12 et des folates est d'intervenir au niveau cellulaire dans la synthèse de l'ADN sans intervenir dans celle de l'ARN. Une carence se traduira par un trouble cellulaire très particulier dans lequel le noyau et la division cellulaire (ADN) seront affectés alors que le cytoplasme et la maturation cellulaire (synthèse protéique, ARN) seront peu touchés. Il s'agit d'un asynchronisme de maturation nucléocytoplasmique qui définit le terme de mégaloblastose. La connaissance des métabolismes de la vitamine B12 et des folates permet de comprendre les causes et les thérapeutiques possibles des anémies mégaloblastiques.
Vitamine B12
La vitamine B12 est indispensable à la synthèse d'acide thymidilique, donc à la synthèse de l'ADN lors de la multiplication cellulaire. Elle est hydrosoluble et son poids moléculaire est de 1335 daltons. Elle existe dans l'organisme sous plusieurs formes désignées par le terme de cobalamines.
Chez l'homme, l'origine des cobalamines utilisées pour l'hématopoïèse est exclusivement alimentaire. Absente des végétaux, elle est apportée par la consommation de produits d'origine animale. Les végétaliens stricts sont donc sujets à des carences. Les aliments courants les plus riches sont la viande, le foie, les oeufs et le lait.
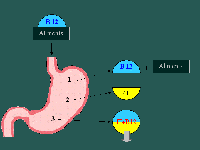 Les cobalamines alimentaires sont libérées des complexes protéiques par la sécrétion gastrique (HCL et pepsine). Libérée des complexes, la vitamine B12 doit se lier à une glycoprotéine synthétisée par les cellules pariétales de l'estomac : le facteur intrinsèque (FI). Cette étape est indispensable à l'absorption ultérieure. Parmi les causes d'anémie mégaloblastique, on retrouve les gastrectomies totales (les patients opérés de gastrectomie totale doivent recevoir un traitement substitutif régulier et à vie de vitamine B12 intramusculaire). La présence d'autoanticorps anti-FI (maladie de Biermer) aboutit également à une carence d'absorption de la vitamine B12.
Les cobalamines alimentaires sont libérées des complexes protéiques par la sécrétion gastrique (HCL et pepsine). Libérée des complexes, la vitamine B12 doit se lier à une glycoprotéine synthétisée par les cellules pariétales de l'estomac : le facteur intrinsèque (FI). Cette étape est indispensable à l'absorption ultérieure. Parmi les causes d'anémie mégaloblastique, on retrouve les gastrectomies totales (les patients opérés de gastrectomie totale doivent recevoir un traitement substitutif régulier et à vie de vitamine B12 intramusculaire). La présence d'autoanticorps anti-FI (maladie de Biermer) aboutit également à une carence d'absorption de la vitamine B12.
La vitamine B12 liée au FI, protégée des dégradations enzymatiques, est transportée jusqu'à l'iléon distal. A ce niveau, le complexe FI-vit B12 est reconnu par des récepteurs spécifiques, absents dans la maladie congénitale d'Immerslund. La vitamine B12 traverse la muqueuse et arrive dans la circulation portale.
Dans le plasma, trois protéines porteuses, les transcobalamines, véhiculent la vitamine B12. Les transcobalamines 1 et 3 sont synthétisées par le granulocyte neutrophile et véhiculent la B12 aux organes de réserves (foie). La transcobalamine 2 est synthétisée par l'hépatocyte et transporte la B12 aux cellules utilisatrices (moelle osseuse). La vitamine B12 excédentaire est excrétée dans la bile. Elle subit un cycle entéro-hépatique avec réabsorption au niveau de l'iléon. L'élimination est double, urinaire et digestive.
Folates
Les folates ou vitamine B9 sont aussi des vitamines hydrosolubles indispensables à la synthèse d'acide thymidilique, donc de l'ADN et à la multiplication cellulaire.
Chez l'homme les folates sont rapportés par l'alimentation : végétaux, céréales, produits d'origine animale. Il s'agit de substances très répandues mais thermolabiles. L'absorption digestive a lieu au niveau du grêle proximal. Après déconjugaison des polyglutamates, les monoglutamates sont réduits en tetrahydrofolates (THF) puis convertis en N5-méthyl-THF qui est la forme unique d'absorption.
Dans le sang, les folates sont à un taux 20 fois plus élevé dans les hématies que dans le plasma. Mais les réserves étant faibles, les carences sont multiples (malnutris, éthyliques, vieillards, cancéreux, grossesses multiples, anémies hémolytiques chroniques).
REMARQUE : A côté des vitamines intervenant dans les mitoses, nommées antimégaloblastiques, d'autres vitamines peuvent être impliquées dans l'érythropoïèse. La vitamine B6 (Pyridoxine) est indispensable à la synthèse de l’hème. Une carence en B6, fréquente lors de traitements antituberculeux, peut entraîner une anémie sidéroblastique. Des carences en vitamine E (alpha tocophérol), en vitamine C (acide ascorbique), ou en vitamine B2 (riboflavine) sont exceptionnellement à l'origine d'anémies.
Facteurs de croissance
Les facteurs de croissance hématopoïétiques sont des glycoprotéines agissant comme des "hormones hématopoïétiques". Cependant, à l'exception de l'EPO, elles sont synthétisées par un grand nombre de cellules présentes dans divers organes : cellules endothéliales, fibroblastes, monocytes/macrophages, lymphocytes. Elles ont aussi le nom de cytokines et pour celles synthétisées par les lymphocytes, de lymphokines et interleukines (IL). Ces cytokines reconnaissent leurs cellules cibles par l'intermédiaire de récepteurs membranaires spécifiques.
On distingue schématiquement 3 types de facteurs de croissance selon leur lieu d'action au cours de l'hématopoïèse:
- Les facteurs de promotion : Ce sont principalement l’IL 6 et le SCF (Stem Cell Factor), le Flt3-ligand, le LIF (Leukemia Inhibitoring Factor). Ils augmentent le nombre de cellules souches en cycle cellulaire et sensibilisent les cellules souches multipotentes à l'action des autres facteurs de croissance.
- Les facteurs multipotents : Ce sont principalement l'IL 3 et le GM-CSF (CSF = Colony Stimulating Factor). Ils agissent sur les cellules souches les plus immatures après sensibilisation par les facteurs de promotion et ils permettent la survie et la différenciation des cellules souches.
- Les facteurs restreints : Ce sont principalement : le G-CSF (lignée granuleuse neutrophile), le M-CSF (lignée monocytaire), l'IL 5 (lignée granuleuse éosinophile), l'IL 4 (lignée granuleuse basophile), l'IL 6 (lignée mégacaryocytaire), l'EPO (lignée érythroïde), la TPO (thrombopoïétine, mégacaryocytaire). Ils agissent sur les cellules souches engagées et favorisent la multiplication cellulaire et la maturation des précurseurs.